癌症发生的细胞机理
从细胞的层面上来看,正常的细胞拥有一定的细胞周期,细胞核中的DNA控制指导着细胞的生长、分裂和凋亡。但在偶然的条件下,DNA不可避免地会受到外部环境或者生物体内部因素的影响,产生损伤。通常,DNA可以进行自身修复或者开启细胞凋亡程序,从而保证细胞的健康存在。但如果控制细胞分裂的DNA序列部分受到损害,DNA将无法修复自身,同时细胞凋亡程序引入失效。此时,细胞的生长和分裂将脱离控制,不受控制的分裂导致更多有基因缺陷的细胞产生,这就是癌细胞。

图1肿瘤生成机理
癌细胞不断增殖,就会积聚形成肿瘤,伴随着肿瘤增大,它们甚至会生成自身的血管,正是这些新生的血管为癌细胞转移提供了便利。癌细胞转移是癌症致人死亡的主要原因。肿瘤细胞不像正常细胞,会老老实实呆在原地,它们会突破血管壁,进入到附近的血管中,在人体血管中“旅行”。这可能导致它在人体其他区域扎根,形成实体肿瘤。
除了通过血管转移,癌细胞另一个转移的途径是淋巴系统,肿瘤中的癌细胞通过附近的淋巴管进入淋巴结,一旦突破淋巴结组成的免疫屏障,肿瘤细胞会停留在淋巴结内增生,或者刺激淋巴细胞增生,导致淋巴结肿大,形成淋巴结转移瘤。之后癌细胞继续通过淋巴系统向远端淋巴结扩散。虽然淋巴结遍布人的全身,但在临床上淋巴转移一般表现为区域性转移。尽管如此,由于淋巴管最终与血管相通,恶性肿瘤细胞可以随淋巴液进入静脉,所以,淋巴道转移最终可能会导致血道转移。
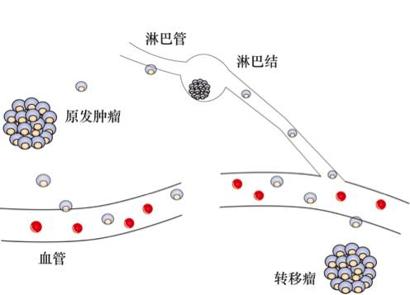
图2癌细胞转移途径
总体来说,癌症细胞就像是身体中的好细胞转变的“坏分子”,并且它们具有极强的增殖能力,还会向整个身体扩散。因此,科学家们急需要做的,就是在癌细胞、肿瘤产生初期就消灭掉它们,或是及时阻止它们的扩散。
传统癌症治疗的机理和缺陷
目前,临床上采用的传统的治疗方式主要有三种,化疗、放疗和手术治疗,这也是人们最为熟知的三种治疗方式。由于癌细胞和正常细胞的区别在于细胞分裂是否可控,在了解这三种治疗方式之前,我们需要详细了解一下细胞的生命周期。如果不通过手术直接把癌细胞移出人体,那么要杀死癌细胞,一定需要在细胞的生命周期中进行操作。
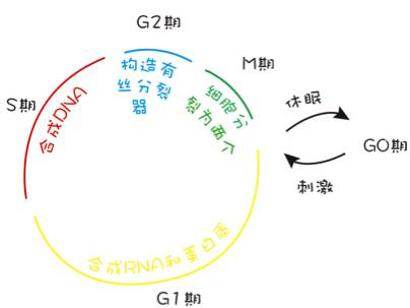
图3细胞周期
细胞周期可以分为图中标示的五个时相,G0期:细胞休止期;G1期:合成RNA和蛋白质;S期:合成DNA;G2期:构造有丝分裂器;M期:细胞分裂为两个细胞。经过M期分裂后,部分细胞会进入到休止期,根据细胞类型不同,这一时期可能持续几个小时甚至很多年,在受到信号刺激之后重新进入G1期。另外一部分细胞则直接进入G1期,开始新的周期循环。癌细胞中也存在G0期细胞,但处于休止期的细胞不易杀灭,因此G0期细胞在癌症治疗中是一个很大的障碍,同时也是肿瘤复发的根源。
化疗
化疗,顾名思义,是指通过化学药物对癌症进行治疗。化疗药物分为细胞周期特异性药物和细胞周期非特异性药物。所谓细胞周期特异性药物,是指药物只攻击处于某一特定细胞周期的增殖期细胞,比如,抗代谢类药物主要作用于S期细胞,属于S期特异性药物;所谓细胞周期非特异性药物,则是指药物除了能够杀死处于各个时相(G1、S、G2、M)的增殖期细胞,还能够杀死部分G0期细胞,但不是全部。由此可知,化疗后人体内仍然存有一些G0期(即休止期)癌细胞,它们在受到外界信号刺激之后会重新进入G1期开始新的周期循环,这就给癌症复发留下了祸根。
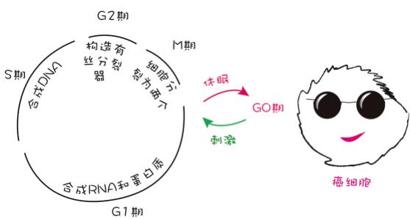
图4 G0期细胞难以消灭
所以,化疗药物通常与其他治疗方式联合使用。单化疗药物而言,它对处于增殖期的癌细胞杀伤效果明显,比如急性髓性白血病、侵袭性淋巴瘤这类快速发展的癌症。但对于生长速度缓慢的肿瘤,其中大部分肿瘤细胞处于休止期,对化疗药物并不敏感。所以化疗药物不适用于所有癌症类型。除此之外,癌细胞的耐药性——尤其是多药耐药性,也使化疗药物的使用受到局限。多药耐药性是指癌细胞在接触一种抗癌药后,会产生对多种结构不同、作用机制各异的其它抗癌药的耐药性,这也是化疗失败的主要原因。所以,单化疗药物而言,它无法做到对癌细胞“赶尽杀绝”,在某些情况下甚至派不上用场。
放射治疗
放疗,是指通过高能射线杀死癌细胞的一种治疗方式。放射治疗属于电离辐射,射线在通过人体组织时会形成离子,这些离子可以直接损伤肿瘤细胞的DNA,从而杀死肿瘤细胞或抑制肿瘤细胞生长。

图5放射治疗机理
在放疗中,电离辐射的能量越高,穿透组织的深度就越深。同时,快速分裂的细胞比处于休止期的细胞对射线更为敏感。因此,辐射的类型和剂量、细胞的生长速度决定着细胞能否被杀死和被杀死的速度。对于生长缓慢的肿瘤,其中可能存在大量处于休止期的细胞,对辐射的剂量要求较高,但过高可能会对正常细胞造成比较大的伤害,剂量过低,则有可能使癌细胞残留,肿瘤复发。这就要求放射治疗的工作人员对电离辐射的类型、剂量有比较精准的掌控,对肿瘤区域进行精准定位,尽可能减少对周围正常组织的伤害。同时根据病人肿瘤的位置和大小,制定最佳的放疗方案。放射治疗作为局部治疗的方法,可以单独使用,也可以和其他治疗方式联合使用。
手术治疗
在癌症治疗中,利用手术直接切除肿瘤也是一种常见的方式。癌症手术分为开放手术和微创手术。在开放手术中,医生需要开一个大的创口切掉肿瘤和部分附近健康的组织,或者肿瘤附近的淋巴结。在微创手术中,医生只需要切出几个小口,插入腹腔镜,使用特殊的工具插入到其他的切口来切除掉肿瘤和周围的组织。微创的切口比开放手术小,更有利于病人恢复,医生会根据病人的具体情况选择手术方式。
但手术治疗并不适用于所有的癌症患者。接受手术会对身体造成一定的创伤,降低人的免疫力,病人的身体状况能否承受手术是必须要考虑的因素。另外,对敏感部位的肿瘤(如,脑瘤)进行手术也存在很大的风险。手术治疗是一种局部治疗的方法,对于局部有实体肿瘤的病人是适用的,对白血病患者或者癌细胞已经扩散的患者效果甚微。
化疗、放疗和手术治疗是目前临床上较为常用的三种治疗癌症的方式,医生会根据病人的病情选择其中一种或交叉使用。它们各有优劣,但总体来说,在杀死癌细胞或肿瘤的同时,对病人健康的细胞都有不同程度的伤害,不利于病人的恢复,副作用较大。科学家一直在思索改进这些治疗方式,希望能利用癌细胞的特性,对癌细胞进行定向攻击,减少对正常细胞的伤害。20世纪末期,随着科学界对细胞中分子层面认知的深入,分子靶向治疗的概念浮出水面。
分子靶向治疗
科学家们逐渐发现,正常细胞内存在着固定的信号通路指导细胞的生长、增殖、分化、凋亡、免疫等行为,是一个程序化的存在。而与正常细胞相比,癌细胞中的一些基因发生了突变,相应的蛋白分子表达异常,分子的行为偏离轨道。正是这些变化最终导致癌细胞快速生长、分裂和转移。科学家们根据已知的细胞内信号通路,对细胞分子表达进行对比分析,最终把目光锁定在细胞中的原癌基因和抑癌基因上。

原癌基因和抑癌基因本来只是基因家族中的合法公民,它们在调控细胞的生命活动中起着关键的作用。原癌基因的蛋白产物负责激活细胞生长和增殖的信号通路,就像一个油门,经过多重蛋白传置,为细胞的生长增殖添加动力;抑癌基因的蛋白产物负责激活促进细胞凋亡、抑制细胞增殖、DNA损伤修复等的信号通路,控制细胞的生长,并能为这个过程中出现的错误及时刹车,它们合作维持着细胞的正常生长状态。
但若人体受到外部环境或生物内部因素的影响,比如受到放射性物质、化学物质或病毒等的侵害,就可能引起基因突变。而癌症的发生就与原癌基因和抑癌基因的突变直接相关。原癌基因突变可能会活化成为癌基因,相应的蛋白产物发生过量表达。这相当于细胞在没有接收到外界生长指令的情况下,油门不间断工作,持续激活细胞增殖或生存通路,使细胞增殖失控,形成癌细胞。抑癌基因突变,则相应的蛋白产物不发生表达。相当于细胞的生长和增殖失去了刹车,细胞凋亡程序失效,受损的细胞无法修复且持续增殖,成为癌细胞。
总的来说,针对癌症的形成,在分子层面可以表达为两点:一个是原癌基因活化,一个是抑癌基因失活,以及它们相应的蛋白分子表达异常(目前发现的原癌基因和抑癌基因已经有100多种)。在了解了这些之后,科学家们惊喜地发现,这些差异可以把癌细胞与正常细胞区分开来。靶向杀灭癌细胞而保全正常细胞,这个想法的实现在隐隐地向人类招手。因此,利用分子为标签靶向消灭癌细胞的药物研发的大幕就此拉开了。1997年,FDA批准了首个靶向药物利妥昔单抗,商品名为美罗华,用于治疗弥漫性大细胞性B细胞淋巴瘤。目前,针对不同的癌症类型,FDA已经批准了70多种肿瘤靶向药物。
靶向治疗的药物形式一般有两种,一种是单克隆抗体,一种是小分子药物。单克隆抗体属于大分子蛋白,不易进入细胞,与肿瘤细胞外表面的特定分子进行靶向结合。小分子药物足够小,能够轻易进入细胞内部,直接靶向肿瘤细胞内的分子,对于靶向肿瘤细胞内部的分子具有优势。目前,人类已经发现了100多种原癌基因和抑癌基因,科学家们正以它们为靶点设计出越来越多的分子靶向药物,基因突变结合器官逐渐成为疾病的基本特征。在临床实践上,分子靶向治疗确实减小了药物的副作用,使病人的生存质量得到很大改善,而且靶向治疗可以大幅延长患者的生存时间。这给很多患癌病人带来了新的希望。
但靶向药物仍然存在一定的局限性。首先,并不是所有的患者都适合服用靶向药,在此之前,医生需要对病人进行基因测序,看是否有相应的基因突变。目前有很多罕见的基因突变还没有相应的药物开发出来。另外,即使有相应的基因突变,有一部分病人在服用了药物之后可能并没有什么响应。对于对药物有积极响应的病人,由于肿瘤细胞会对药物产生耐药性,药物有可能在短时间内失效。肿瘤细胞对靶向药物产生耐药性的机制有很多种,比如,肿瘤建立代偿信号通路,即我们在通过药物抑制了一种细胞增殖信号通路之后,细胞有可能激活另外一条信号通路刺激细胞的增殖。因此,在临床实践上通常会联合使用几种分子靶向药物,或者联合其他治疗方式,来增强治疗效果。
这也就是说,人类其实对分子靶向的认识极其有限,可以说是冰山一角。但幸运的是,世界各大医药公司都在致力于对肿瘤细胞的研究和分子靶向药物的开发。同时,在这个互联网时代,大数据被认为是能够拓宽和加深人们对靶向药物认识的有力工具。试想,如果我们把世界上每一个癌症病人的基因序列整理到共享数据库中,针对其中某种或某几种基因突变,使用何种药物获得怎样的治疗效果都记录在册,那么对于有相同基因突变的病人,我们是否可以更快地识别出哪个基因突变是关键的突变,进而对病人制定出最佳的治疗方案。除此之外,科学家们对癌细胞中的分子机理也可以理解地更为透彻,对开发新一代的靶向药物大有帮助。这对于推动展现出极大潜力、但在实践中总让人看不清套路的分子靶向技术来说,似乎是一个强有力的措施。
随着基因测序成本的逐渐降低,越来越多的癌症病人选择进行基因测序,基因组数据呈现爆炸式增长,这一想法变为现实也呈现出更多可能性。虽然在过去大多数时候,由于涉及到个人隐私、商业机密以及法律限制,这些数据碎片式地散落在世界各地的医院和研究机构中,但近年来此领域吸引了诸如IBM,谷歌和美国临床肿瘤协会等的重度参与,他们正致力于建立诊疗大数据,并启用了人工智能系统加入数据分析的行列。
自从1809年,Ephraim McDowell在没有使用麻醉药的情况下在美国做了第一个卵巢肿瘤切除手术,到1889年英国伦敦皇家医院的助理医师Stephen Paget开始对肿瘤的发生和转移进行思考,提出“种子与土壤”假说,直到今天,人类发现癌细胞内分子的异常表达,致力于发展分子靶向治疗策略,已经过去了200多年的时间。结合基础学科的发展,人类经过不断地思考和摸索,使手术治疗、放射治疗、化疗和靶向治疗依次走向临床,不断地给患者带来新的希望。目前的治疗方法虽然无法彻底治愈癌症,但已经可以延长患者的寿命。在笔者看来,癌症治愈的根本在于认清癌细胞的本质,而不是一味地杀死癌细胞。因为往往认清事物中存在的问题,比急着找到正确的答案更值得花费时间和力气。人类对于癌症治疗的研究正走在这样一条道路上。科学家们正努力深入探索癌细胞内的分子机理,同时,继人类基因图谱构建之后,科学家们当前也在着力于细胞图谱的构建,企图破译出人体中每个细胞的类型和特性,以及细胞之间的相互作用,为人类开发药物提供一个全新而精细的生物学模型。历史的车轮滚滚向前,科学也在不断发展,究竟哪种策略能够最终彻底治愈癌症,唯有时间来给出答案。
参考文献:
1.http://www.who.int/mediacentre/factsheets/fs297/zh/
2.《病理学》/冷静,冯一中主编,北京:科学出版社,2001.08
3.http://large.stanford.edu/courses/2012/ph241/ali1/docs/003019-pdf.pdf
4.http://www.lifeomics.com/mag/v12v13/pdf/1_4lifeomics_v12v13_090203.pdf
5.http://www.gjzlx.cn/fileup/PDF/z2013211.pdf
6.http://www.tumorsci.org/rhtml/m00001/2015/35/8/926.html
7.http://www.sciencedirect.com/science/article/pii/S2542364917300596
8.http://ascopubs.org/doi/full/10.1200/jco.2009.25.7261



